コミナティ筋注(ファイザー社 COVID-19ワクチン)6ヵ月の有効性について
国内の新型コロナウイルス(COVID-19)ワクチン接種率が1回目接種が50%を超え、2回目接種が40%を超えるようになりました。
2021年9月4日時点(1回目接種率51.55%、2回目接種率41.05%)
国内で特例承認されて以降、継続されているはずのコミナティ筋注(ファイザー社COVID-19ワクチン)の臨床試験成績の追加発表がありません。
その後の臨床試験のデータが気になったので、2021年7月28日にファイザー社が発表した論文の詳細データから考察することにしました(今回は有効性についてのみ行っています)。
コミナティ筋注の特例承認時のデータ(中央値2ヵ月の観察期間)
PMDA審査報告書
申請資料概要
※日本人での有効性の評価はされていません
海外での臨床試験成績(中央値2ヵ月の観察期間)の中間報告で、米国・欧州で緊急使用され、それによって日本でも特例承認されました。
COVID-19感染確定の判定
COVID-19 感染確定例は、PCR検査陽性と判定され、以下の症状のうち少なくとも一つが認められた者です。
● 発熱
●新たな咳嗽または咳嗽の悪化
●新たな息切れまたは息切れの悪化
●悪寒
●新たな筋肉痛または筋肉痛の悪化
●新たな味覚または嗅覚の消失
● 咽喉痛
●下痢
●嘔吐
●疲労
●頭痛
●鼻閉または鼻汁
●悪心
有効性の主要評価項目
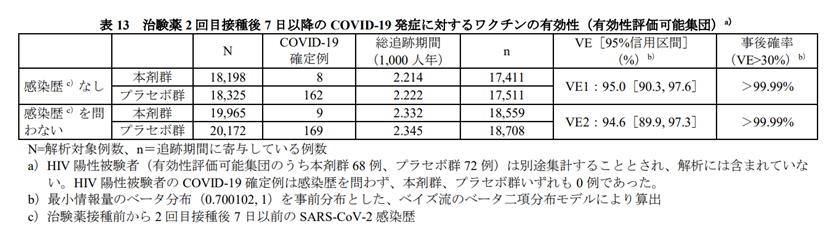
〇SARS-CoV-2に感染歴がない被験者集団での2回目接種7日後から評価したCOVID-19 発症のワクチン効果(中央値2ヵ月の観察期間)
ワクチン接種 8人/18198人(0.044%)
プラセボ接種 162人/18325人(0.884%)
VE1(ワクチン効果・相対リスク減少率) 95%
絶対リスク減少率、NNTを計算すると、
絶対リスク減少率 0.84%
NNT 約119人
〇SARS-CoV-2に感染歴を問わない被験者集団での2回目接種7日後から評価したCOVID-19 発症のワクチン効果(中央値2ヵ月の観察期間)
ワクチン接種 9人/19965人(0.045%)
プラセボ接種 169人/20172人(0.838%)
VE2(ワクチン効果・相対リスク減少率) 94.6%
絶対リスク減少率、NNTを計算すると、
絶対リスク減少率 0.79%
NNT 約126人
相対リスク減少率・絶対リスク減少率・治療必要数(NNT)については、関連記事をご参照ください ↓
NNT119人という意味は、ワクチンを接種した119人のうちの1人が、COVID-19感染防止できるベネフィットがあり、その他118人はワクチンを打っても打たなくても同じ結果ということです。
臨床試験のこの時点での感染率では、ワクチン接種するベネフィットがあまり大きくないと言えます。
パンデミックの大きさ(感染率)が、得られるベネフィットに影響を与えます。関連記事をご参照ください ↓
有効性の副次評価項目
COVID-19 の重症化抑制効果(2 回目接種後 7 日時以降)
COVID-19 の重症化抑制効果については、以下の一つ以上の状態が認められることと規定されています。
●重度全身性疾患を示唆する安静時の臨床的徴候(呼吸数 30 回/分以上、心拍数 125 回/分以上、SpO2 93%以下又は PaO2/ FiO2 300 mmHg 未満)
●呼吸不全(高流量酸素療法、非侵襲性換気、機械換気又は体外式膜型人工肺(ECMO)による治療が必要)
●ショック(収縮期血圧 90 mmHg 未満、拡張期血圧 60 mmHg 未満、又は昇圧剤の投与が必要)
● 急性腎機能障害、肝機能障害又は神経系機能障害
● 集中治療室への入室
●死亡
〇治験ワクチン接種前および接種期間中の感染歴がない被験者
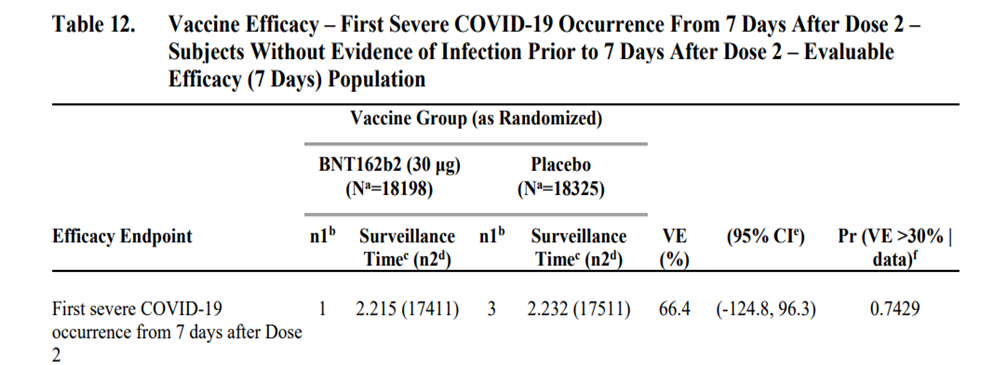
治験ワクチン接種前および接種期間中の SARS-CoV-2 感染歴がない被験者において、重症COVID-19 確定例(2 回目接種後 7 日時以降)は BNT162b2 群 1 例、プラセボ群 3 例であり、BNT162b2 の VE 66.4%(-124.8, 96.3)となり有意差なし。
〇治験ワクチン接種前および接種期間中の感染歴の有無を問わない被験者
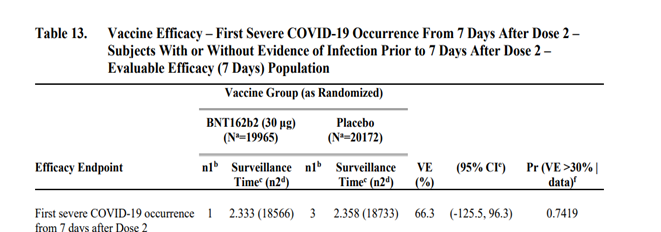
治験ワクチン接種前および接種期間中の SARS-CoV-2 感染歴の有無を問わない被験者において、重症 COVID-19 確定例(2 回目接種後 7 日時以降)は BNT162b2 群 1 例、プラセボ群 3 例であり、BNT162b2 の VE は 66.3%(-125.5,96.3)となり有意差なし。
重症化確定例数が少なく、重症化を防ぐ効果を示すことができていません。
ワクチン接種の真の目的は(真のエンドポイント)は、COVID-19感染による重症化による死亡を防ぐことです。
真のエンドポイントについては、関連記事をご参照ください ↓
ファイザーの論文データ(最大6ヵ月の観察期間)
2021年4月1日ファイザー社プレスリリース
その後、2021年4月1日にファイザー社よりプレスリリースがあり、ワクチンの第3相試験の最新の解析結果が公表されました。
しかし、その詳細データはいっさい公表されていませんでした。
以下がその内容です。
今回の46,307名の参加者を対象とした解析結果は、以前に公表したデータを裏付けるものであり、本ワクチンの2回目接種から6ヵ月間におけるCOVID-19に対する強力な発症予防効果が実証されました。本試験で確定診断された症候性のCOVID-19 927名のうち、プラセボ群は880名、BNT162b2群は77名で、発症予防効果は91.3%[95%信頼区間(89.0, 93.2)]でした。
コミナティ筋注(ファイザー社 COVID-19ワクチン)6ヵ月の有効性について
ファイザー社が正式承認に向けて、論文で試験データを公開しました。
Six Month Safety and Efficacy of the BNT162b2 mRNA COVID-19 Vaccine
論文プレプリント2021.7.28 https://doi.org/10.1101/2021.07.28.21261159
Full Text Supplementary Material
2021.9.15に査読後の論文が掲載されています
Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine through 6 Months
N Engl J Med. 2021 Nov 4;385(19):1761-1773.doi: 10.1056/NEJMoa2110345.
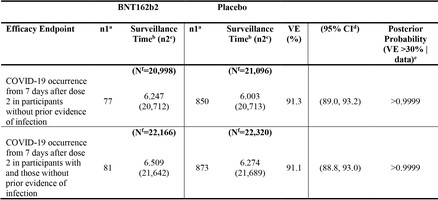
〇SARS-CoV-2に感染歴がない被験者集団での2回目接種7日後から評価したCOVID-19 発症のワクチン効果(最大6ヵ月の観察期間)
ワクチン接種 77人/20998人(0.367%)
プラセボ接種 850人/21096人(4.03%)
VE1(ワクチン効果・相対リスク減少率) 91%
絶対リスク減少率、NNTを計算すると、
絶対リスク減少率 3.66%
NNT 約27人
〇SARS-CoV-2に感染歴を問わない被験者集団での2回目接種7日後から評価したCOVID-19 発症のワクチン効果(最大6ヵ月の観察期間)
ワクチン接種 81人/22166人(0.365%)
プラセボ接種 873人/22320人(3.91%)
VE2(ワクチン効果・相対リスク減少率) 91%
絶対リスク減少率、NNTを計算すると、
絶対リスク減少率 3.55%
NNT 約28人
主要評価項目でのVE(ワクチン効果・相対リスク減少率)は91%という高い数字を維持しており、プラセボ群での感染率が高くなった為、NNTから考察するベネフィットもよくなっています。
しかし、論文の詳細データをみると、かなり大きな問題があることがわかりました。
論文データの問題点
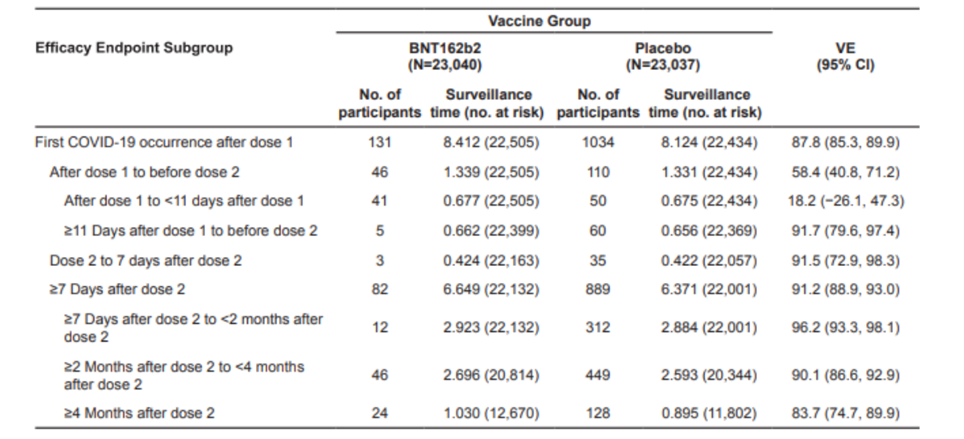
2020年12月より参加者の盲検化を解除して、プラセボ投与者に対して、ワクチン接種を許可しています。
2021年3月13日(データカットオフ)までに、41128人/44060人(93.3%)の盲検化が解除されています。
4ヵ月盲検化が維持されたのが各群51%ずつで、6ヵ月盲検化が維持されたのが、ワクチン投与者の8%、プラセボ投与者の6%と極めて低い数字となっています。
最初にプラセボを投与された被験者のほとんどにワクチンを投与し、プラセボ対照試験を終了してしまっています。
実際に6ヵ月の観察期間を追跡できたのは、わずか7%程度の被験者しかいません。平均追跡期間は約4.4ヵ月であり、6ヵ月間のVE(ワクチン効果)を示したと言えるような臨床試験ではありませんでした。
まとめ

コミナティ筋注(ファイザー社COVID-19ワクチン)は、2ヵ月間の臨床試験データの中間解析により、緊急使用許可を得て、世界中でワクチン接種されるようになりました。
国内でも海外での緊急使用実績により特例承認され、国民の過半数がワクチン接種を行っています。
その後も継続するはずの臨床試験は、盲検化を解除してプラセボ群にもワクチン接種を行ってしまいました。
実際に6ヵ月の観察期間を追跡できたのは、わずか7%程度の被験者しかいません。
実質的に臨床試験はもう継続されていない状況だと言えます。
この臨床試験の結果では、2回目のワクチン接種により6ヵ月間のVE(ワクチン効果)を示したとは判断できません。
この臨床試験では、2ヵ月間という短期間の有効性しか示すことができないのです。
つまり特例承認時のデータ以外に、信頼できるようなデータはもうないということです。
だから、その後の臨床試験の結果が報告されてこないのです。
2021年8月23日に米国FDAはファイザー社COVID-19ワクチンを正式承認しました。
当初2023年1月まで臨床試験が行われる予定だったファイザー社COVID-19ワクチンですが、1年5ヵ月も前倒しての承認となりました。
冬に向かって、これから感染者が増加していくはずの日本国内でも、3回目のワクチン接種(ブースター接種)が議論されるようになると思われます。
しかし、一番信頼できるはずの臨床試験のデータは、もうこれ以上は参考にはできません。
今回は有効性についてしか記載していませんが、ワクチン接種のリスクとベネフィットについては、関連記事をご参照ください ↓
中長期的な潜在的リスクである、抗体依存性感染増強(ADE)については、関連記事をご参照ください ↓
追加接種(ブースター接種)については、関連記事をご参照ください ↓





