創傷からの癒着「フィブリンとコラーゲン」

私たちは加齢によって、筋肉組織が硬くなって動かしにくくなっていきます。
その原因の1つが、コラーゲンの代謝回転が低下することにあります。
糖化によるAGEsの蓄積によって、非酵素的にコラーゲン架橋(老化架橋)を形成して、筋膜の剛性の増加や粘弾性特性に変化が起こります。
糖化やAGEsについては、関連記事をご参照ください ↓
コラーゲン線維の架橋については、関連記事をご参照ください ↓
そして、もう一つの大きな原因が、傷が治る過程で生じる癒着にあります。
私たちの体が傷ついた後、組織の修復を行いますが、その際に瘢痕化が起こって癒着を生じる場合があります。
筋骨格系の損傷と修復

日本血栓止血学会誌 2020;31 (4) :373-380
プラスミン
プラスミンは、組織型プラスミノゲンアクチベータ(tPA)及びウロキナーゼ型プラスミノゲンアクチベータ(uPA)により前駆体プラスミノゲンが分解されて生成する線溶系タンパク質です。
筋骨格系損傷が発生すると、まずは出血の制御、組織の低酸素化の制御といった急性の反応が起こります。
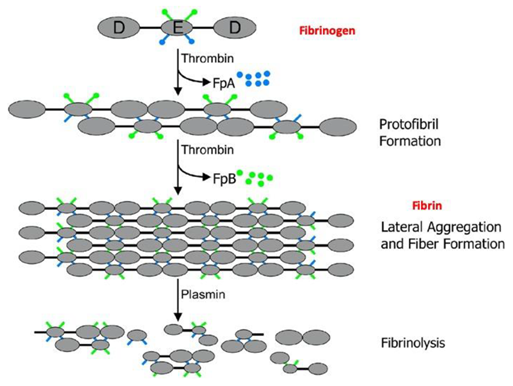
まず凝固系が活性化し、フィブリンが血管内外に沈着して、止血作用を示します。
血管内フィブリンは血栓となり血液漏出を防ぎ、血管外フィブリンは損傷組織内で細胞外マトリックスとなり、組織修復を保護します。
フィブリンマトリックスにおいて、tPAやuPAによりプラスミノゲンからプラスミンに分解され活性化し、フィブリンを分解して、低酸素状態を改善し組織機能を回復させます。
プラスミンは炎症反応を促進させ、損傷した壊死組織などの除去に作用します。
プラスミンはVEGFの産生を促進させ、血管新生を導くことにより、局所の低酸素状態を改善します。
組織修復は、フィブリン形成から惹起されるプラスミン活性といった過程が制御されてはじめて完成します。
このバランスが崩れると、筋骨格系損傷後、組織修復の失敗が起こると、組織変性や細胞外マトリックスの変性を招き病的状態となります。
骨折修復の過程
骨折によって、血行に富んだ骨には血管の破綻が発生し、出血が起こるため、止血のためにフィブリンが産生されます。
損傷部位でのトロンビンがフィブリンと血小板凝集をもたらし出血を止め、好中球が治癒促進のため局所の炎症を促進します。
フィブリン沈着と好中球活性により、αMβ2インテグリンを表面上にもつマクロファージが活性化し、それがインターロイキン1,6やTNFαといったサイトカイン産生を促します。
フィブリンならびに遊走マクロファージの表面に結合したプラスミノゲンはプラスミンに変換されます。
このプラスミンは組織に蓄積したフィブリンを除去することによって、修復過程を促進するとともに抗炎症マクロファージを活性化します。
マクロファージによって壊死組織とフィブリン分解産物が除去され、さらに間葉系細胞が浸潤します。
さらにプラスミンは骨折部のPro-MMP9やVEGFといった成長因子を活性化し、組織のリモデリングと血管新生を促進します。
すなわち、損傷組織とフィブリンの除去により、一度破断した血管新生が起こり、骨形成が進んでいきます。
マクロファージについては、関連記事をご参照ください ↓
骨の圧電性については、関連記事をご参照ください ↓
筋修復の過程
筋損傷に伴いフィブリンの沈着が起き、プラスミン活性は受傷後3~5日でピークに達し、M2マクロファージを通してフィブリンと壊死組織を除去し、再生血管が起こり筋衛星細胞が増殖します。
筋衛星細胞が活性化され、筋芽細胞を経て、筋細胞へと分化します。
そして複数の筋細胞が融合し、多核の筋管となり、新たな筋線維が形成され、それがもとの筋線維と融合することによって骨格筋が再生されます。
骨損傷と同様、筋肉の損傷後に産生された細胞外基質の溶解が非常に重要です。
プラスミンの活性低下により、マクロファージの遊走の低下やフィブリンの蓄積による慢性的な炎症がもたらされます。
損傷部位の筋修復が損なわれ、石灰化を生じて異所性骨化を形成する原因となります。
図は Type I Collagen-Fibrin Mixed Hydrogels: Preparation, Properties and Biomedical Applications
Gels. 2020 Oct 20;6(4):36. doi: 10.3390/gels6040036. より引用
修復過程でできたフィブリンが、うまく分解除去されずに沈着することが、癒着を形成するきっかけになります。
肉芽組織はコラーゲン線維が架橋化して密に繊維化した瘢痕組織となって、癒着を形成する原因になります。
これが筋膜(細胞外マトリックス)の可動域制限の原因となって、関節など組織の動きを制限することになります。
筋膜性疼痛症候群(MPS)については、関連記事をご参照ください ↓
コラーゲン線維のひずみと非線形弾性と粘弾性

Strain-enhanced stress relaxation impacts nonlinear elasticity in collagen gels
Proc Natl Acad Sci U S A. 2016 May 17;113(20):5492-7. doi: 10.1073/pnas.1523906113.
変形に対する耐性は、変形が短い時間スケールで増加するにつれて強化されます。
ひずみ硬化と呼ばれる動作ですが、長い時間スケールでは粘性流体のいくつかの特性を示します。
コラーゲンマトリックスのひずみ硬化が、液体のような挙動と結びついていることを示しています。
変形が大きくなると、これらのマトリックスは硬くなりますが、流動が速くなり、この剛性の増加が緩和されます。
これらの複雑な機械的挙動は、これらのマトリックスとの細胞相互作用に関連している可能性があります。
非線形弾性を示し、ひずみ硬化を受けることです。ただし、これらのゲルは粘弾性もあり、応力緩和を示し、変形に対するゲルの耐性は時間の経過とともに緩和されます。
ひずみが増加すると、生体高分子ゲルが硬化するだけでなく、より速い応力緩和を示し、弾性エネルギーが散逸するタイムスケールが減少します。
これらのネットワークは非線形弾性であり、ひずみ硬化、またはネットワークのひずみが増大するにつれて弾性が増加することが明らかです。
この非線形弾性は、血栓の主成分として機能するフィブリンゲルの特徴でもあります。
中間径フィラメントと細胞骨格アクチンネットワークの再構成されたネットワークでも機能します。
ひずみが増加すると、コラーゲンおよびフィブリンゲルの応力緩和が速くなります。
コラーゲンとフィブリンのゲルはひずみが発生すると硬化しますが、ひずみが強化された応力緩和により、ひずみの硬化は時間の経過とともに減少します。
コラーゲン・フィブリンも筋膜リリースの技術により、粘性変形をすることが可能です。
コラーゲン線維の粘弾性変形については、関連記事をご参照ください ↓
まとめ

加齢によるコラーゲン線維のリモデリング(代謝回転)の低下は、糖化によるAGEsによる架橋形成によって、コラーゲン線維の剛性を増加させます。
創傷の治癒過程で生成するフィブリンの沈着は、組織と細胞外マトリックス(筋膜)の癒着の原因となります。
コラーゲン線維とフィブリン線維は、非線形弾性という同じような特徴を示します。
短い時間での変形に対しては耐性を示しますが、長い時間スケールでの変形に対しては粘性変性を示します。
筋膜リリースの技術によって、コラーゲンやフィブリンなど癒着した線維に粘性変性を起こさせることは可能です。





