ウイルス感染とメカノバイオロジー

新型コロナウイルス(SARS-CoV-2)の発生は、世界的なパンデミックが引き起こしました。
ウイルス感染は複雑で多様なプロセスがあり、ウイルスと宿主の間の生化学的および分子的相互作用の研究が行われています。
今回はメカノバイオロジーの視点から、細胞骨格とメカノセンサーが、ウイルス感染を調節していることを説明します。
新型コロナウイルス(SARS-CoV-2)が細胞に侵入する仕組み

How the coronavirus infects cells — and why Delta is so dangerous
Nature. 2021 Jul;595(7869):640-644. doi: 10.1038/d41586-021-02039-y.
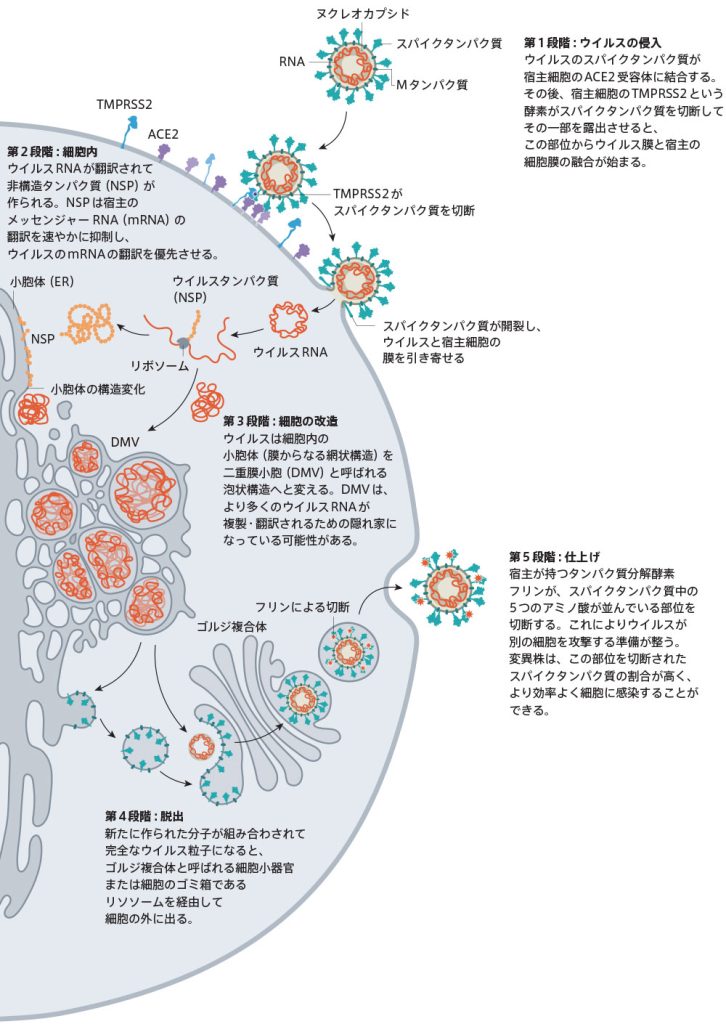
SARS-CoV-2のウイルス粒子の外側にはエンベロープと呼ばれる脂質膜があり、その表面には24~40個のスパイクタンパク質が無造作に並んでいます。
このスパイクタンパク質が、ウイルスがヒト細胞に融合する際のカギとなります。
ウイルスのスパイクタンパク質がACE2に結合すると、宿主細胞の表面にある他のタンパク質が、ウイルスの膜を宿主の細胞膜と融合させるプロセスを開始します。
SARS-CoV-2は、呼吸器細胞の外側に大量にあるTMPRSS2(タンパク質分解酵素)を効率よく利用します。
TMPRSS2は、スパイクタンパク質のS2サブユニットの特定の部位を切断し、スパイクタンパク質の疎水性アミノ酸の並びが露出するようにします。
これらのアミノ酸は、一番近くにある膜(宿主細胞膜)の中に速やかに潜り込みます。
次に、長く伸びていたスパイクタンパク質が折り畳まれることで、ジッパーを閉じるようにウイルスと細胞膜が融合します。
細胞膜と融合したウイルスは、細胞内に直接ゲノムを放出します。
ウイルスが自分のRNAゲノムを細胞内に放出すると、細胞質中のリボソームがウイルスRNAの2つのセクションを翻訳して長いアミノ酸配列を作ります。
この長いアミノ酸は切断されて、16種類のタンパク質となり、そこから多くのウイルスRNAが作られます。
これらのRNAには、新しいウイルス粒子を作るのに必要なスパイクタンパク質をはじめとする構造タンパク質など、合計26種類の既知のウイルスタンパク質がコードされています。
ウイルスはこうして自分自身のメッセンジャーRNA(mRNA)のコピーを作り始めようとします。
また、ウイルスが細胞の外に出る際には、新しいウイルスの感染力の増強するため、5個のアミノ酸からなる配列が切断されます。
次の標的となる細胞に侵入しやすい準備を整えて、感染力を高めています。
スパイクタンパク質とコロナ後遺症・ワクチン後遺症については、関連記事をご参照ください ↓
ウイルス感染とメカノバイオロジー

How Physical Factors Coordinate Virus Infection: A Perspective From Mechanobiology
Front Bioeng Biotechnol. 2021 Oct 29;9:764516. doi: 10.3389/fbioe.2021.764516.
メカノバイオロジー
メカノバイオロジーは、組織、細胞、および細胞外マトリックスによる細胞内外の物理的要因に対する感覚、伝達、および応答に焦点を当てています。
細胞レベルでは、アクチンフィラメント、微小管、および中間径フィラメントを含む細胞骨格は、さまざまな結合タンパク質を含む動的な細胞骨格構造を構成しています。
細胞外の機械的負荷を感知・伝達して、周囲の細胞外マトリックス に機械的合図を送ります。
メカノバイオロジーにおける代謝調整については、関連記事をご参照ください ↓
細胞外マトリックスについては、関連記事をご参照ください ↓
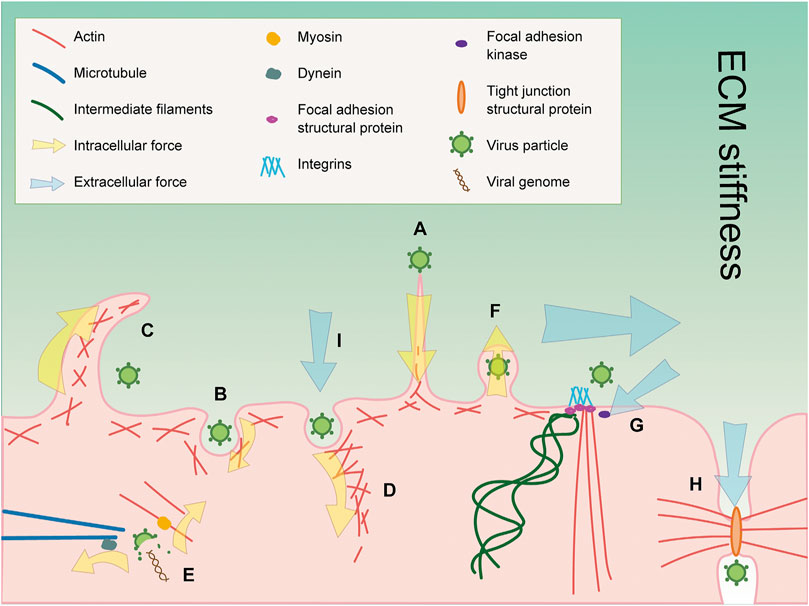
細胞骨格と機械的(力学的)情報を感知するメカノセンサーは、ウイルス感染時に重要な役割を果たしています。
細胞骨格の微小管とアクチンフィラメントは、ウイルスの侵入から、脱コーティング、複製、排出まで、ライフサイクルのすべての段階に力を影響させています。
細胞外の機械的シグナルは、さまざまなメカノセンサーによって細胞に伝達され、一連の細胞力学的変化につながります。
焦点接着は、細胞内アクチン束と細胞外マトリックスの間に機械的リンクを形成する、インテグリンを含む構造タンパク質複合体です。
焦点接着は、細胞外マトリックスと相互作用する細胞間での機械的な力と調整シグナルが伝達されるメカノセンサーとなります。
細胞間結合には、密着結合(タイトジャンクション)、接着結合、接着斑(デスモソーム)があり、細胞内および細胞外環境からの力を感知し、機械的シグナルを伝達して環境への細胞の適応を促進するメカノセンサーとなります。
ウイルスは、特定の受容体に結合した後、侵入に適した部位に移動する必要があります。
このプロセスはウイルス サーフィンと呼ばれ、細胞体に向かうウイルスのアクチン依存性の動きとなります。
ウイルスの大部分は、アクチンネットワークの重合と成長を制御および調節し、クラスリンを介したエンドサイトーシスで膜の陥入を生成して侵入します。
ウイルスの排出の際には、アクチン核形成は、ウイルスを膜ピットから細胞外環境に追い出す原動力となります。
メカノセンサー・気圧と自律神経反応については、関連記事をご参照ください ↓
新型コロナウイルスのメカノバイオロジー

Mechanical activation of spike fosters SARS-CoV-2 viral infection
Cell Res. 2021 Oct;31(10):1047-1060. doi: 10.1038/s41422-021-00558-x.
新型コロナウイルス(SARS-CoV-2 )のスパイクタンパク質 は、ACE2 を含む宿主受容体を認識して、複雑な生体力学的環境でウイルスの侵入を開始します。
宿主細胞膜の曲げによって生成される引張力が、ACE2 のSARS-CoV-2スパイク認識を強化し、S2 サブユニットからのS1 サブユニットの分離を加速し、宿主細胞への侵入を促進します。
メカノ活性化(機械的な力の影響)が、宿主ACE2受容体と結合するウイルススパイクの結合寿命を延長しています。
感染による細胞の機械的変化
ウイルス感染は、細胞力学によって調節されるだけでなく、細胞力学の変化も引き起こします。
感染によって引き起こされる細胞の機械的変化は、細胞骨格の再編成とダイナミクスであります。
細胞の剛性、細胞の運動性、ウイルス感染に対する感受性など、細胞特性の変化につながります。
細胞の力学変化は、ミトコンドリアの代謝にも影響を与えます。
ミトコンドリアのエネルギー代謝については、関連記事をご参照ください ↓
力学と代謝・ミトコンドリアダイナミクスについては、関連記事をご参照ください ↓
自然免疫とミトコンドリア代謝については、関連記事をご参照ください ↓
まとめ

新型コロナウイルス(SARS-CoV-2)のウイルス粒子が、宿主であるヒト細胞に融合して感染する際のカギとなるのは、スパイクタンパク質です。
宿主細胞膜の曲げによって生成される引張力が、ACE2 のSARS-CoV-2スパイク認識を強化し、S2 サブユニットからの S1 サブユニットの分離を加速し、宿主細胞への侵入を促進します。
機械的な力の影響が、宿主ACE2受容体と結合するウイルススパイクの結合寿命を延長しています。
ウイルス感染は、細胞力学によって調節されるだけでなく、細胞力学の変化も引き起こします。
感染によって引き起こされる細胞の機械的変化は、細胞骨格の再編成とダイナミクスであります。
細胞の剛性、細胞の運動性、ウイルス感染に対する感受性など、細胞特性の変化につながります。





