「癌細胞と代謝」代償的な代謝経路の活性

私たちの細胞では、低酸素や不適な栄養下でも、生き延びようとする代謝系の調整が行われています。
ホメオスタシスによる代謝調整が、生存のための代謝経路のリプログラミングに発展する場合があります。
リプログラミングにより、代償的な代謝経路を不可逆的に獲得したのが、癌細胞です。
過酷な環境下を脱した後でも、ミトコンドリアの損傷の有無にかかわらず、リプログラミングされた代謝系によって、強い栄養欲求を満たして過剰にエネルギーを産生することを続けています。
グルコースの代謝経路とその調整

グルコースの正常な代謝は、解糖系(Glycolysis)とミトコンドリアの酸化的リン酸化(OXPHOS)によるエネルギー代謝が80~90%です。
残り10~20%の多くは、ペントースリン酸経路(PPP)によって、NADPHや、デオキシリボース、リボースといった核酸の生合成に不可欠な糖を供給します。
このグルコースの代謝が正常に行われなくなることが、様々な病気の根源になっています。
しかしそれもまた、体の細胞が生き延びようとするホメオスタシスの働きによる調整です。
①細胞内ATPが過剰に存在する場合
細胞内のATP濃度によって、解糖系(Glycolysis)の酵素の活性が制御されています。
ATPがたくさんある時は、Glycolysisからのエネルギー代謝は抑制されて、ペントースリン酸経路(PPP)などによって、細胞の成分となる遺伝子(核酸)や脂肪酸合成(FAS)のためにグルコースが消費されます。
解糖系酵素のホスホグリセリン酸キナーゼ(PGK)の細胞内ATP濃度による制御機構
Molecular mechanism of glycolytic flux control intrinsic to human phosphoglycerate kinase
Proc Natl Acad Sci U S A. 2021 Dec 14;118(50):e2112986118. doi: 10.1073/pnas.2112986118.
②脂肪酸のエネルギー代謝が行われている場合
脂肪酸代謝によって、解糖系(Glycolysis)の酵素の活性が低下します。
ランドルサイクル(グルコース‐脂肪酸サイクル)によって、血中から遊離脂肪酸の取り込みが増え、グルコースの取り込みが抑制されます。
ミトコンドリアでは脂肪酸のβ酸化によってアセチルCoAを生成して、TCAサイクルを回して、酸化的リン酸化(OXPHOS)を行います。
ランドルサイクルについては、関連記事をご参照ください ↓
③細胞内の低酸素状態、交感神経反応
虚血による低酸素レベルや、無酸素運動などによる交感神経反応(闘争・逃走 反応)では、解糖系(Glycolysis)によって生成したピルビン酸は、ミトコンドリア内に入らず乳酸に変換されます。
ミトコンドリアでの酸化的リン酸化(OXPHOS)が行われません。
交感神経反応(闘争・逃走 反応)については、関連記事をご参照ください ↓
④ミトコンドリア呼吸鎖複合体(電子伝達系)が障害される
ミトコンドリアの電子伝達系の複合体タンパク質が変性して障害されると、グルコースのエネルギー代謝における解糖系(Glycolysis)とミトコンドリアの酸化的リン酸化(OXPHOS)の共役できなくなります。
タンパク質を変性させる活性酸素種(ROS)や低分子アルデヒド誘導体については、関連記事をご参照ください ↓
グルコース代謝の副経路の活性化

解糖系(Glycolysis)の酵素の活性が低下すると、細胞内でのグルコース代謝が抑制されます。
解糖系(Glycolysis)の律速酵素であるフルクトキナーゼ(PFK)は、フルクトース‐6-リン酸 からフルクトース‐1,6-二リン酸を合成する反応を触媒する酵素です。
この酵素は、脂肪酸のエネルギー代謝の亢進や、ミトコンドリアの酸化的リン酸化(OXPHOS)障害によっても、活性が低下します。
ポリオール経路
解糖系での活性低下したフルクトキナーゼ(PFK)の酵素反応を、バイパスするのがフルクトース代謝(Fructolysis)です。
グルコースが、アルドースレダクターゼ(AR)によって還元されて、ソルビトールを生成します。
生成したソルビトールは、ソルビトールデヒドロゲナーゼによって、フルクトースに変換されます。
この内因性のフルクトースは、ケトヘキソキナーゼ(KHK)によって、フルクトース-1-リン酸に変換された後、グリセルアルデヒドとジヒドロキシアセトンリン酸に切断されます。
解糖系経路に途中から入って、エネルギー代謝されたり、中性脂肪合成の基質となっていきます。
ポリオール経路は、高血糖時には糖代謝の30%以上に上昇すると考えられています。
フルクトース代謝(Fructolysis)については、関連記事をご参照ください ↓
内因性フルクトースの意味と代謝調整については、関連記事をご参照ください ↓
ヘキソサミン経路
Glycolysisでは、フルクトキナーゼ(PFK)によって、フルクトース‐6‐リン酸からフルクトース‐1,6-二リン酸を合成します。
ヘキソサミン経路では、フルクトース‐6‐リン酸にグルタミンが付加され、グルコサミン-6-リン酸(GlcN6P)が合成されます。
この反応は、ヘキソサミン経路の律速酵素である、グルタミンフルクトース‐6-リン酸アミドトランスフェラーゼ(GFAT)によって触媒されます。
最終的には UDP-N アセチルグルコサミン(UDP-GlcNAc)が生合成されます。
通常では、糖代謝の2~3%程度ですが、GlycolysisのPFKの抑制により、このヘキソサミン経路が亢進します。
①癌細胞の代謝変化 好気性解糖・グルタミノリシス

酸化的リン酸化(OXPHOS)によるエネルギー代謝でATP産生ができないと、細胞機能が障害されます。
そのような状況下でも、生存するための代償的な代謝経路を不可逆的に獲得したのが、癌細胞といえます。
代謝酵素の活性変化を獲得して、ピルビン酸キナーゼの発現増強によりピルビン酸生成を促進します。
またピルビン酸デヒドロゲナーゼを抑制し、ピルビン酸からアセチルCoAの生成を阻害し、ミトコンドリアでのエネルギー産生を抑制します。
解糖系で生成したピルビン酸は、乳酸デヒドロゲナーゼによって乳酸に変換されます。
ワールブルク効果 (Warburg effect)
癌細胞やその他の増殖性の高い細胞では、酸素の存在下でも、ミトコンドリアの酸化的リン酸化(OXPHOS)とは脱共役して、解糖系(Glycolysis)による乳酸生成を促進します。
このような代謝型は、「好気性解糖」あるいは「ワールブルク効果」と呼ばれています。
ワールブルク効果 は、多様な環境ストレスに応答して、さまざまな細胞型での耐性メカニズムとして機能します(癌細胞に特定されるものではありません)。
癌と生体電気については、関連記事をご参照ください ↓
癌細胞での酸塩基平衡については、関連記事をご参照ください ↓
グルタミノリシス(Glutaminolysis)
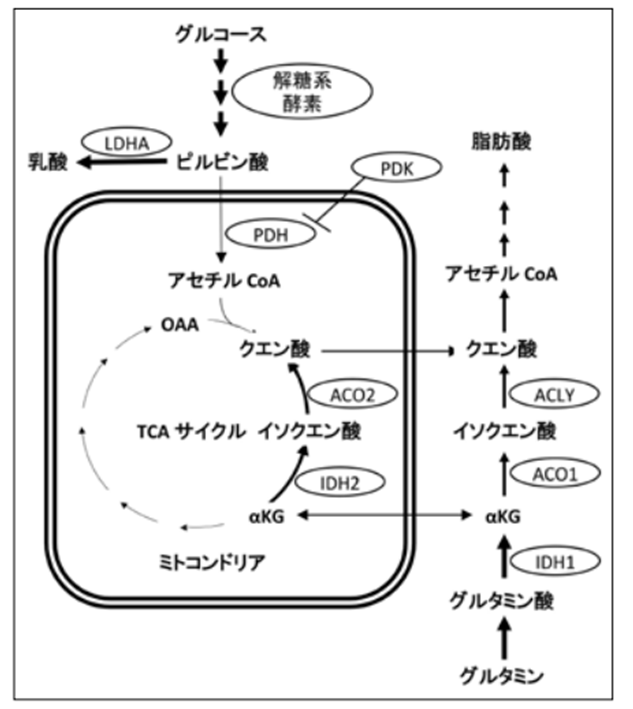
図は 日本静脈経腸栄養学会雑誌 3(40):907-910:2015 より引用
癌細胞は、ミトコンドリアに入る別のエネルギー源としてグルタミンを大量に消費します。
グルタミンはアミノ酸トランスポーターASCT2 / SLC1A5を介して細胞に入り、グルタミナーゼ(GLS)によって触媒される脱アミノ化反応を介してミトコンドリアでグルタミン酸に変換されます。
グルタミン酸は、グルタミン酸デヒドロゲナーゼ(GDH)またはアラニンまたはアスパラギン酸トランスアミナーゼ(TA)のいずれかによって、TCA回路の中間体であるα-ケトグルタル酸(α-KG)に変換されます。
低酸素症やミトコンドリア機能障害においても、α-KGは、IDH2によって触媒される還元的カルボキシル化反応でクエン酸塩に変換できます。
新しく形成されたクエン酸塩はミトコンドリアを出て、そこで脂肪酸を合成(FAS)することができます。
好気性解糖により生成する乳酸のアシドーシスを、グルタミンの分解により生成するアンモニアで中和して、解糖系の反応を進める役割も担っています。
②癌細胞の代謝変化 ミトコンドリアの脂肪酸酸化(FAO)亢進

The Role of Mitochondrial Fat Oxidation in Cancer Cell Proliferation and Survival
Cells. 2020 Dec 4;9(12):2600. doi: 10.3390/cells9122600.
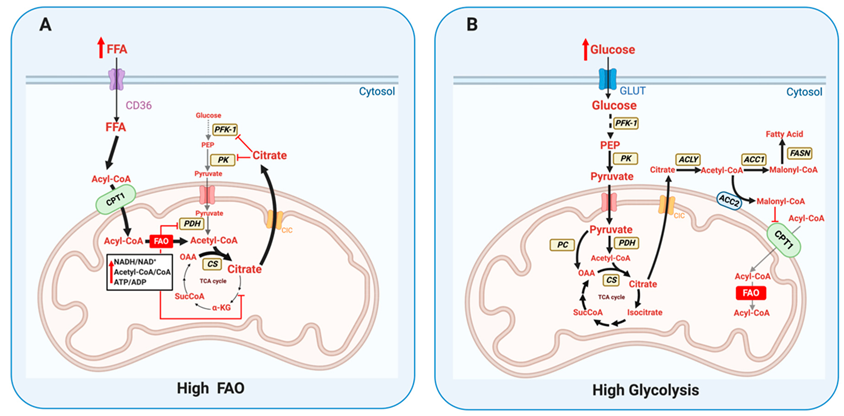
通常はグルコースの代謝と脂肪酸の代謝は、ランドルサイクルによって説明されるように、代謝酵素の活性制御によって、同時に進むことはありません。
近年、癌細胞において、脂肪酸合成(FAS)やペントースリン酸経路(PPP)などの異常に活性化された代謝経路に加えて、脂肪酸酸化(FAO)が過剰に活性化されていることが確認されています。
ワールブルク効果による解糖系の亢進による脂肪酸合成(FAS)と、ミトコンドリアでの脂肪酸酸化(FAO)を同時に促進する代謝を獲得しています。
β酸化クエン酸-リンゴ酸シャトル(β酸化シャトル)
A “Weird” Mitochondrial Fatty Acid Oxidation as a Metabolic “Secret” of Cancer
Oxid Med Cell Longev. 2022 Feb 8;2022:2339584. doi: 10.1155/2022/2339584.
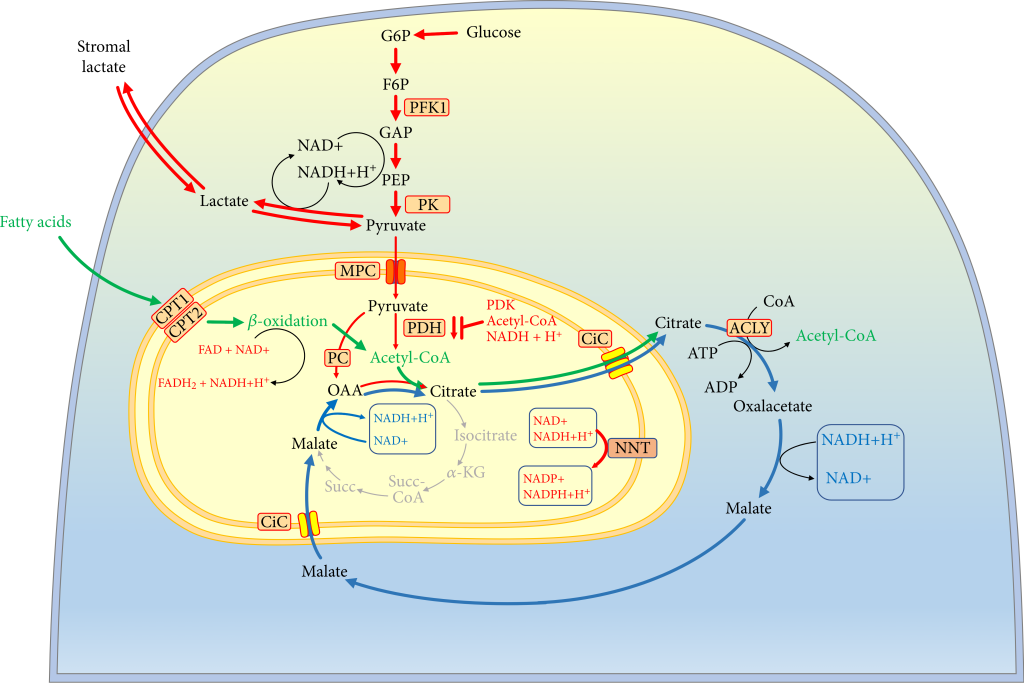
エネルギー燃料としてグルコースから脂肪酸へのシフトは、複合体Iを介したRETによるROS生成の増加により、複合体Iのダウンレギュレーションが起こります。
ミトコンドリア脂肪酸β酸化(mFAO)の活性酸素種(ROS)生成については、関連記事をご参照ください ↓
ミトコンドリアのβ酸化の過剰活性化は、特に低酸素状態で、電子伝達系およびTCA回路の機能障害を引き起こします。
結果として生じる細胞の過剰還元された酸化還元状態は、代償経路を引き起こします。
FASおよびメバロン酸経路による過剰産生されたクエン酸塩の利用の増加により、クエン酸-リンゴ酸シャトルにリンクさせます。
β酸化-クエン酸-リンゴ酸シャトル、すなわち「β酸化シャトル」という特殊な代謝経路が活性化させます。
「 β酸化シャトル」での酸化的リン酸化(OXPHOS)は、解糖系(Glycolysis)と拮抗しません。
解糖系でのピルビン酸を乳酸に変換することで、NADHを消費してNAD+を生成して、ミトコンドリアマトリックスでの還元状態を減少させます。
脂肪酸酸化(FAO)と解糖系亢進による脂肪酸合成(FAS)に同時に依存できるようになるのです。
まとめ

私たちの体は、代謝によって生命を維持するためのATP(エネルギー)や、新陳代謝するための細胞の構成成分を合成しています。
グルコースのエネルギー代謝は、解糖系(Glycolysis)とミトコンドリアの酸化的リン酸化(OXPHOS)が正常に行われることが非常に重要です。
通常、低酸素状態や脂肪酸酸化(FAO)の過剰活性化により、ミトコンドリアの酸化的リン酸化(OXPHOS)が障害されると、アポトーシスを起こして細胞死につながります。
主な代謝経路に障害が起きると、それを代償する代謝経路が活性化していきます。
代謝酵素(タンパク質)の活性変化を獲得して、代償的な代謝経路を不可逆的に獲得したのが、癌細胞です。
リプログラミング(遺伝子変異)が起こるということは、代謝酵素(タンパク質)の構造に変化が起こっているのです。
グルタミノリシス(Glutaminolysis)が活性化し、ワールブルク効果により好気性解糖(Glycolysis)による脂肪酸合成(FAS)を促進します。
また、ある種の癌細胞では、TCA回路を迂回する代償経路を獲得して、脂肪酸酸化(FAO)と解糖系(Glycolysis)による脂肪酸合成(FAS)を同時に行うことが可能になっています。
ランドルサイクルを克服する代謝経路をリプログラミングされたのです。





